Учёные получили криоэлектронную структуру и атомарную модель переноса комплекса интасомы ВИЧ-1
Учёные получили криоэлектронную структуру и атомарную модель переноса комплекса интасомы ВИЧ-1.
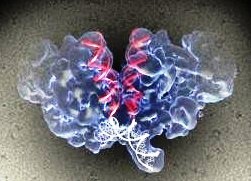
Структуру интасомы ВИЧ получили на новом уровне разрешающей способности.
В январе 2017 года в журнале Science команда учёных опубликовала статью о применении метода криоэлектронной микроскопии для изучения структуры интасомы ВИЧ-1, что позволило им разрешить противоречия имевшихся в предыдущих описаниях моделей сборки интасом.
Существенным шагом в жизненном цикле лентивирусов, таких как ВИЧ-1, является встраивание вирусной ДНК в геном хозяина, что влечёт за собой постоянное инфицирование клетки. Фермент вирусная интеграза катализирует этот процесс и является основной мишенью для лекарственных препаратов. Во время вирусной интеграции, интеграза связывает концы вирусной ДНК, образуя структуру высшего порядка, которая называется интасома. Ранее интасомы ВИЧ были недоступны исследованиям структуры с высоким разрешением. Криоэлектронная микроскопия позволяет ученым получить изображение больших, сложных и динамичных молекул.
В новом исследовании, Dario Oliveira Passos Lyumkis и его коллегам, удалось прикрепить к интрасоме специфический белок, повышающий её растворимость в растворах, погрузить её глицерол, с добавлением солей, предотвращающих её от слипания. Затем, они провели криоэлектронную микроскопию, используя при этом большее количество электронов, чем обычно и получили структуру интасомы, которая оказалась сложнее, чем у других лентивирусов.
Это исследование поможет в разработке лекарственных препаратов, а также в понимании механизмов резистентности ВИЧ к лекарственным средствам.
DOI: 10.1126/science.aah5163
