На прошедшей конференции ASM Microbe 2016 (Бостон, 16-20 июня) несколько докладов было посвящено перспективному ингибитору интегразы ВИЧ компании Gilead биктегравиру (bictegravir, GS-9883).
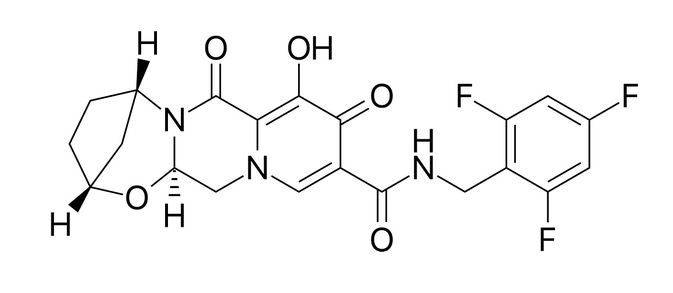
На прошедшей конференции ASM Microbe 2016 (Бостон, 16-20 июня) несколько докладов было посвящено перспективному ингибитору интегразы ВИЧ компании Gilead биктегравиру (bictegravir, GS-9883). Данный препарат прошел несколько фаза доклинических исследований и I фазу клинических испытаний.
Scott Lazerwith и другие разработчики Gilead вели поиск нового ингибитора переноса цепи интегразой (ИИ, INSTI) на базе молекулярной структуры, известной как кольцо A, эта структура была дополнена структурой, которая должна обеспечить лучшее связывание с интегразой ВИЧ и высокие параметры метаболической стабильности. Период полувыведения молекулы составил 19 часов, что позволяет применять препарат в режиме дозирования один раз в день.
Исследования профиля резистентности препарата показали высокую активность как в отношении дикого типа ВИЧ, так и в отношении типов, устойчивых к препаратам из классов НИОТ, ННИОТ и ингибиторам протеазы ВИЧ. Новый препарат оказался устойчивее к мощным мутациям устойчивости к ИИ, превосходил долутегравир, и тем более ралтегравир и элвитегравир.
В рамках первой фазы клинических испытаний 20 пациентов с ВИЧ, как наивных, так и ранее получавших АРВ-препараты, получали биктегравир в виде монотерапии в течение 10 дней. Участники были рандомизированы на прием плацебо или биктегравира в дозах 5, 25, 50 и 100 мг.
Биктегравир показал высокий профиль безопасности и хорошо переносился во всех дозах. В двух случаях пациенты отмечали головную боль, в трех — диарею. За 10 дней терапии биктегравиром во всех случаях и для всех доз была продемонстрирована высокая вирусологическая активность, в одном случае (доза 50 мг) к 10 дню терапии пациент успел достичь вирусной нагрузки менее 50 копий в мл.
Для дальнейших стадий клинических исследований выбрана доза 50 мг. Судя по некоторым доклиническим исследованиям высока вероятность появления препарата в комбинации с тенофовира алафенамидом и эмтрицитабином (TAF/FTC).
